L’acétylène est un gaz incolore, très soluble dans l’acétone et très inflammable. C’est le chimiste français Marcellin Berthelot qui en 1862 a réussi le premier à le préparer par la décharge d’un arc électrique entre deux électrodes de graphite dans une atmosphère d’hydrogène.
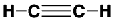
C’est Henri Moissan qui en 1892 ouvrit la voie à une préparation pratique de l’acétylène en découvrant le carbure de calcium C2Ca par réaction du graphite sur la chaux à haute température, dans un four électrique de son invention. En effet, le carbure de calcium se décompose par action de l’eau pour mener à l’acétylène. Les réactions sont les suivantes :
CaO + 3C —> C2Ca + CO
CaC2 + 2 H2O —> C2H2 + Ca(OH)2 + 31 kcal
Utilisations de l’acétylène
Au début des années 1900, on pensait que l’éclairage public pouvait être le lot de l’acétylène produit localement par cette voie, mais très vite le gaz de ville d’origine houillère, moins coûteux, supplanta l’acétylène. Cependant, les lampes à acétylène eurent un très large usage. Pendant des années elles ont été les compagnes des mineurs avec la flamme plus ou moins bien protégée de l’atmosphère des galeries, pour éviter les explosions avec le gaz de grisou. Les lanternes de vélo, les lanternes d’automobiles fonctionnaient, avant les dynamos et alternateurs, avec l’acétylène issu de l’hydrolyse du carbure de calcium. En même temps qu’il fallait faire le plein d’essence, il fallait aussi faire le plein de carbure et régler finement le pointeau du goutte à goutte d’eau, garant d’une alimentation et flamme régulière.
On a souvent dit que l’acétylène avait une odeur alliacée, en réalité les impuretés du carbure calcium produisaient des phosphines, arsines et de l’hydrogène sulfuré qui donnaient ces odeurs désagréables.
C’est grâce au français Charles Picard entre 1901 et 1910 et d’après une idée d’Henry Le Chatelier remontant à 1895, que le chalumeau oxy-oxyacétylénique fut inventé. La chaleur de combustion et les produits de réaction plutôt réducteurs permettaient de monter à près de 3 000°C et ainsi de fondre et souder les métaux. Après les travaux de Georges Claude sur la séparation de l’oxygène de l’air et la possibilité de dissoudre l’acétylène dans l’acétone sous pression sur un support poreux, le soudage et le découpage des aciers prirent une nouvelle dimension.
La chimie de l’acétylène a été particulièrement riche entre 1914 et 1950, les réactions d’addition avec le chlore, l’acide cyanhydrique, le formol, l’oxydation, conduisant au chlorure de vinyle, à l’acrylonitrile, au butadiène, à l’acide acétique… Cette carbochimie, finalement basée sur le charbon, est maintenant remplacée par la pétrochimie liée au craquage des coupes légères du pétrole et donc par la chimie de l’éthylène, plus facile à obtenir et mettre en œuvre, moins dangereux et moins coûteux. De nos jours, l’acétylène est obtenu par combustion partielle du méthane ou séparé de l’éthylène dont il est un sous-produit dans l’opération de craquage.
La pensée du jour
« En 1900, les coureurs du Tour de France ne se dopaient pas, ils carburaient. »
Sources
– http://fr.wikipedia.org/wiki/Acétylène
– http://en.wikipedia.org/wiki/Acetylene
– http://encyclopedia.airliquide.com/encyclopedia.asp?GasID=1&LanguageID=2&CountryID=19
– www.acethylene.com/
– http://fr.wikipedia.org/wiki/Lampe_Acétylène
– www.chalumo.fr.st/

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie 

