Parmi les briques élémentaires de la pétrochimie et plus particulièrement les BTX (cf. Éthylène), les xylènes ne sont pas vraiment les petits derniers du fait de leur oxydation en les acides dicarboxyliques correspondants dont les tonnages produits annuellement en font de grands intermédiaires de la chimie organique industrielle.
Lors du reformage du naphte, les isomères ortho, méta et para du xylène et l’éthylbenzène (cf. Styrène) sont obtenus dans les proportions thermodynamiques qui sont à 400 °C : m-xylène : 47,5 %, p-xylène : 23 %, o-xylène : 22,5 %, éthylbenzène : 7 %. Malheureusement, le m-xylène, majoritaire, est le moins utile : son isomérisation est possible, à des températures inférieures à 150 °C avec des catalyseurs de Friedel et Crafts (cf. Charles Friedel), à partir de 250 °C avec des zéolithes, ou à partir de 380 °C avec des aluminosilicates amorphes ou des alumines halogénées.
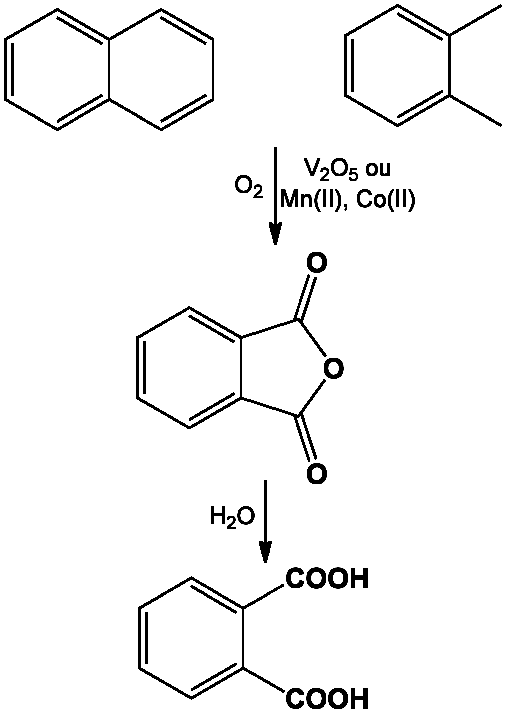
Bien que l’acide phtalique soit d’importance commerciale modeste, l’anhydride phtalique, dérivé étroitement lié, est un intermédiaire produit à grande échelle. L’acide phtalique a été obtenu en 1836 par Auguste Laurent en oxydant le tétrachloronaphtalène. Pensant que la substance en résultant était un dérivé du naphtalène, il l’appela acide naphtalénique. C’est le chimiste suisse Jean Charles Galissard de Marignac qui en détermina la formule correcte. Les méthodes de fabrication au XIXème siècle ont inclus l’oxydation du tétrachloronaphtalène par l’acide nitrique, ou mieux, l’oxydation du naphtalène par l’acide sulfurique au contact de mercure ou de son sulfate comme catalyseur, suivie de son hydrolyse.
Si l’anhydride phtalique précurseur est toujours produit par l’oxydation catalytique du naphtalène au contact d’oxyde de vanadium, V2O5, il est de plus en plus produit directement à partir de l’o-xylène, soit en phase gazeuse au contact d’oxyde de vanadium, soit en phase liquide en présence de sels solubles de cobalt (cf. Cobalt), manganèse (cf. Manganèse) ou molybdène.
Les acides iso- et téréphtaliques sont obtenus par oxydation des xylènes correspondants par le dioxygène de l’air en utilisant l’acide acétique comme solvant et un catalyseur à base de sels de cobalt et de manganèse et un promoteur à base d’ions bromure (cf. Brome). Dans ce procédé développé par la société Amoco, le rendement est proche de 95 % avec une sélectivité en diacide supérieure à 99 %. Le produit brut est purifié par hydrogénation en solution aqueuse pour transformer les traces d’impuretés, généralement les aldéhydes intermédiaires. Le brome présent dans le milieu réactionnel est un générateur de radicaux libres qui favorisent les réactions d’oxydation des groupes méthyle par le dioxygène (cf. Dioxygène et PBDE et retardateurs de flamme) : en l’absence de brome, l’oxydation s’arrête au stade monocarboxlique.
L’application principale des acides phtaliques concerne l’obtention d’esters et d’amides et de polymères.
Les o-phtalates, communément appelés phtalates, résultent de l’alcoolyse de l’anhydride phtalique. Ils sont à la base de plastifiants employés couramment, car facilement accessibles et bon marché. Pour la petite histoire, ils sont apparus dans les années 1920 en remplacement du camphre, volatil et odorant. En 1931, la disponibilité commerciale du polychlorure de vinyle (cf. Polychlorure de vinyle, PVC) et le développement du phtalate de di-2-éthylhexyle (cf. Rhodium) comme plastifiant a lancé le PVC.
La réaction débute par l’ouverture de l’anhydride phtalique par un alcool ROH, conduisant au monoester :
C6H4(CO)2O + ROH ———> C6H4(CO2H)CO2R
La deuxième estérification est plus difficile et exige le déplacement de la molécule d’eau : C6H4(CO2H)CO2R + ROH ———> C6H4(CO2R)2 + H2O
Le diester le plus important est le phtalate de di-2-éthylhexyl (DEHP), utilisé dans la mise en forme du PVC. Les phtalates sont utilisés depuis 50 ans et sont produits à raison de 4 Mt/ an. Ce sont des plastifiants utilisés couramment dans les matières plastiques, les rendant souples, flexibles, améliorant leur tenue aux chocs et au froid, à l’allongement à la rupture et facilitant leur mise en œuvre. Toutefois leur libération dans l’environnement est possible en raison d’une migration au sein de la matrice (due à une incompatibilité avec celle-ci), suivie d’une exsudation et d’une faible volatilité. Ils sont présents dans de nombreux produits de consommation courante. Les cosmétiques sont le deuxième domaine d’application des phtalates où ils sont notamment incorporés comme agents fixateurs afin d’augmenter le pouvoir de pénétration d’un produit sur la peau ou d’empêcher le vernis de craquer.
Les phtalates sont actuellement fortement controversés comme étant des perturbateurs endocriniens (cf. Bisphénol A) et trois d’entre eux, le DEHP, le DBP (phtalate de dibutyle) et le BBP (phtalate de butyle et benzyle) figurent sur la première liste de la réglementation REACH. Le DEHP est maintenant remplacé par les phtalates de di-isonyle (DINP) et de di-isodécyle (DIDP) pour les jouets pour enfants, revêtements de sols, gants, emballages alimentaires et applications médicales.
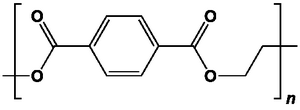
Le téréphtalate de polyéthylène (PET) fut breveté en 1941 par deux chimistes britanniques, John R. Whinfield et James T. Dickson. Ils participèrent aussi à l’invention du Térylène en 1941, marque de fibre textile du groupe ICI, dont les brevets furent rachetés en 1945 par DuPont de Nemours. Ce dernier créa ainsi la fibre Dacron (1950) et le film Mylar (1952). En France, la fibre polyester est apparue en 1954 sous la marque Tergal (pour la petite histoire, formé de « Ter » pour polyester et « gal », pour gallicus : en somme le « polyester gaulois » !).
La fibre de PET est la fibre synthétique la plus produite dans le monde : elle représente environ 70 % des fibres synthétiques utilisées dans le vêtement, dont la dernière innovation, la fibre polaire principalement élaborée à partir de PET recyclé.
Ce n’est pas la seule application du PET : avec les problèmes associés aux plastifiants pour PVC, mais aussi le développement de la consommation de boissons gazeuses, le PET est de plus en plus employé pour l’emballage (bouteilles, films alimentaires, films hybrides avec l’aluminium…), les produits de grande consommation (ameublement, protection d’écrans, cartes de crédit…), expliquant une production de l’ordre de 30 Mt/an d’acides téréphtalique et isophtalique !
Les chlorures d’acide dérivés de ces deux acides sont également l’un des composants des fibres aramides issus de la polycondensation entre la p-phénylène diamine et le chlorure d’isophtaloyle (fibre textile Nomex, résistante à la flamme) ou le chlorure de téréphtaloyle (fibre Kevlar possédant d’extraordinaires propriétés mécaniques).
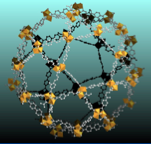
Enfin, last but not least, l’acide téréphtalique est l’une des briques organiques employée en association avec des briques inorganiques pour l’obtention d’une nouvelle famille de matériaux mésoporeux dénommés {hybrides en français et {MOFs en anglais, donnant accès à des composés dont les caractéristiques peuvent être prévues avant synthèse. De tels matériaux offrent des perspectives nouvelles en absorption, catalyse, relargage de substances actives, etc.
Pensée du jour
« L’X des BTX est vraiment polyvalent et polytechnique… »
Sources
– http://en.wikipedia.org/wiki/Phthalic_acid
– http://en.wikipedia.org/wiki/Isophthalic_acid
– http://fr.wikipedia.org/wiki/Acide_téréphtalique
– http://en.wikipedia.org/wiki/Terephthalic_acid
– http://en.wikipedia.org/wiki/Phthalic_anhydride
– http://fr.wikipedia.org/wiki/Phtalate
– http://en.wikipedia.org/wiki/Phthalate
– http://fr.wikipedia.org/wiki/Perturbateur_endocrinien
– http://fr.wikipedia.org/wiki/Polyester
– http://en.wikipedia.org/wiki/Polyester
– http://fr.wikipedia.org/wiki/Polyéthylène_téréphtalate
– http://en.wikipedia.org/wiki/Polyethylene_terephthalate
– http://fr.wikipedia.org/wiki/Aramide
– http://en.wikipedia.org/wiki/Aramide
– http://en.wikipedia.org/wiki/Nomex
– G. Férey, Les nouveaux solides poreux ou les miracles des trous, L’Actualité Chimique 2007, 304, I-XVI
– http://en.wikipedia.org/wiki/Metal-organic_framework
Pour en savoir plus
– Éthylène
– Styrène
– Charles Friedel
– Cobalt
– Manganèse
– Brome
– Dioxygène
– PBDE et retardateurs de flamme
– Bisphénol A
– Polychlorure de vinyle
– Rhodium

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie