Fils d’un fonctionnaire dont la famille était originaire de Stradonice en Bohême, August Kekulé est né à Darmstadt en 1829. Pour la petite histoire, l’accentuation finale aurait été ajoutée par son père lors de l’occupation napoléonienne de la Hesse afin que ses interlocuteurs français prononcent correctement la troisième syllabe.
Après des études au Ludwig-Georgs-Gymnasium de cette ville, où il apprit le français, l’anglais et l’italien, il s’inscrit en 1847 à l’Université de Giessen pour étudier l’architecture. Toutefois, il change rapidement pour la chimie après avoir écouté les cours de Justus von Liebig, ce qui l’amène aussi à étudier à Paris avec Jean-Baptiste Dumas et Charles Frédéric Gerhardt (1851-52). Son doctorat en poche, il séjourne (nous dirions aujourd’hui : {il fait un post-doc…) à Coire (Suisse) chez Adolph von Planta (1852-53), un ancien élève de Liebig, puis à Londres (1854-55) où il est l’assistant d’Alexander Williamson.
En 1856, il obtient son habilitation à l’Université de Heidelberg où il est Privatdozent de 1856 à 1858 : il y aura avec un étudiant du nom d’Adolf von Baeyer des discussions passionnées. En 1858 il obtient, sur la recommandation de Liebig un poste de professeur à l’Université de Gand. Il y reste jusqu’en 1867 lorsqu’il devient professeur à l’Université de Bonn pour le reste de sa carrière.
August Kekulé est avant tout un chimiste théoricien, concerné par la formation des liaisons chimiques et par conséquent la structure chimique. Dès 1819, Jöns Jacob Berzélius décrit les liaisons chimiques comme des interactions entre dipôles. En 1834, Jean-Baptiste Dumas et Auguste Laurent montrent que les liaisons ne sont pas de type dipolaire. Cela met fin à la théorie de Berzélius, qui est alors remplacée par la théorie des types (soit des fonctions chimiques). En 1852, Edward Frankland, le fondateur de la chimie organométallique, parle de « capacité de saturation » ou « d’atomicité » : chaque élément aurait ainsi une certaine capacité d’échange avec les autres éléments.
En 1858, Kekulé, émet deux principes :
– le carbone est tétravalent et toujours tétravalent,
– les composés organiques sont donc constitués par des enchaînements d’atomes de carbone, ayant échangés entre eux, une ou plusieurs unités de saturation (la notion de liaisons multiples sera proposée par Alexander Crum Brown en 1864).
Encore pour la petite histoire, l’écossais Archibald Scott Couper, alors étudiant dans le laboratoire de Charles Adolphe Wurtz, a eu la même idée, mais il présente son article à Wurtz qui ne le transmet pas tout de suite aux {Annales de chimie et de physique. Kekulé publie donc ses résultats avant Couper qui ne le supportera pas et retournera en Écosse : la petite histoire est aussi un éternel recommencement… Couper fut le premier à formaliser les liaisons entre atomes par des traits.
Cette théorie de structure permit la compréhension des molécules organiques et de leurs réactions et conduisit à une véritable explosion des recherches en synthèse des composés organiques à partir de 1860.
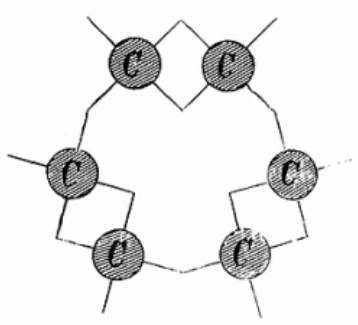
En 1865, toujours à Gand, il travaille depuis des semaines sur la formule développée du benzène (cf. Benzène) dont on connaissait la formule brute C6H6. Aucune des formules qu’il a produites, linéaire ou ramifiée, ne correspond parfaitement avec la monovalence de l’hydrogène (H) et surtout la tétravalence du carbone (C) qu’il venait de proposer. Il suggère enfin une structure cyclique -la première dans l’histoire de la chimie- avec un cycle de six atomes de carbone liés par des liaisons simples et doubles en alternance.
|
Kekulé appuie cette structure en considérant le nombre d’isomères des molécules dérivées du benzène. Pour les benzènes monosubstitués (C6H5X, où X = Cl, OH, CH3, NH2, etc.), un seul isomère est trouvé, ce qui implique que tous les six carbones sont équivalents, de sorte que la substitution sur chaque carbone forme le même produit. Pour les benzènes disubstitués tels que les toluidines C6H4(NH2)(CH3), trois isomères sont observés. Kekulé leur propose des structures auxquelles les deux atomes de carbone substitués sont séparés par une, deux, ou trois liaisons : ce seront respectivement, par la suite, les isomères {ortho, {méta et {para. Encore pour la petite histoire, la première description de la structure du benzène fut publiée en 1865 par Kekulé en français dans le Bulletin de la Société Chimique de Paris, l’ancêtre du Bulletin de la Société Chimique de France. Il est intéressant de noter que près d’un siècle plus tard (1956), la première description de la liaison entre un métal de transition et une oléfine (cf. Éthylène) fut présentée par Michael J.S. Dewar dans le {Bulletin de la Société Chimique de France…
|
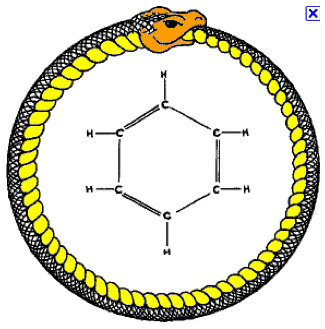
Les six liaisons carbone-carbone sont alors équivalentes, chacune étant liaison simple la moitié du temps et liaison double la moitié du temps. Cette équivalence sera confirmée par la détermination de la structure du benzène par radiocristallographie et recevra une base théorique plus solide, lorsque Linus Pauling remplace l’oscillation de Kekulé par la notion de mésomérie. Il faut se rappeler qu’à cette époque, les méthodes physicochimiques ne permettaient pas la détermination structurale des composés organiques. Seule la chimie préparative associée à la détermination de la composition centésimale et, dans une certaine mesure, des masses moléculaires, constituait l’arsenal d’investigation des chimistes. L’intuition y jouait naturellement un grand rôle. En 1890, la Société chimique allemande fête le 25e anniversaire de son premier article sur le benzène. Kekulé raconte alors que sa théorie avait été créée lorsqu’une nuit, il rêve de l’ouroboros (le serpent gnostique qui se mord la queue) :
Je tournais ma chaise vers le feu et tombais dans un demi-sommeil. De nouveau, les atomes s’agitèrent devant mes yeux […] De longues chaînes, souvent associées de façon plus serrée, étaient toutes en mouvement, s’entrelaçant et se tortillant comme des serpents. Mais attention, qu’était-ce que cela ? Un des serpents avait saisi sa propre queue, et cette forme tournoyait de façon moqueuse devant mes yeux. Je m’éveillai en un éclair […]
Et de conclure : « Apprenons à rêver, mais gardons-nous de rendre publics nos rêves avant qu’ils n’aient été mis à l’épreuve par notre esprit bien éveillé ». Les historiens débattent encore sur la vérité de cette histoire : certains croient que Kekulé l’aurait inventée quand il l’a racontée en 1890.
En 1895, une année avant sa mort, il est anobli par l’empereur Guillaume II et adopte le titre von Stradonitz, en souvenir de la ville de ses ancêtres. Parmi les cinq premiers prix Nobel en chimie, trois sont ses anciens étudiants : J. van’t Hoff en 1901, E. Fischer en 1902, et A. von Baeyer en 1905…
Pensée du jour
«Benzène : serpent de mer du milieu du XIXe siècle dompté par F. A. Kekulé.»
Sources
– http://fr.wikipedia.org/wiki/Friedrich_Kekulé_von_Stradonitz
– http://en.wikipedia.org/wiki/Friedrich_August_Kekulé_von_Stradonitz
– http://de.wikipedia.org/wiki/Friedrich_August_Kekulé_von_Stradonitz
– www.chemheritage.org/discover/chemistry-in-history/themes/molecular-synthesis-structure-and-bonding/kekule-and-couper.aspx
– http://mendeleiev.cyberscol.qc.ca/chimisterie/2001-2002/bolducc.html
– http://members.optusnet.com.au/charles57/Creative/Brain/kekule.htm
– http://histoirechimie.free.fr/index.htm

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie