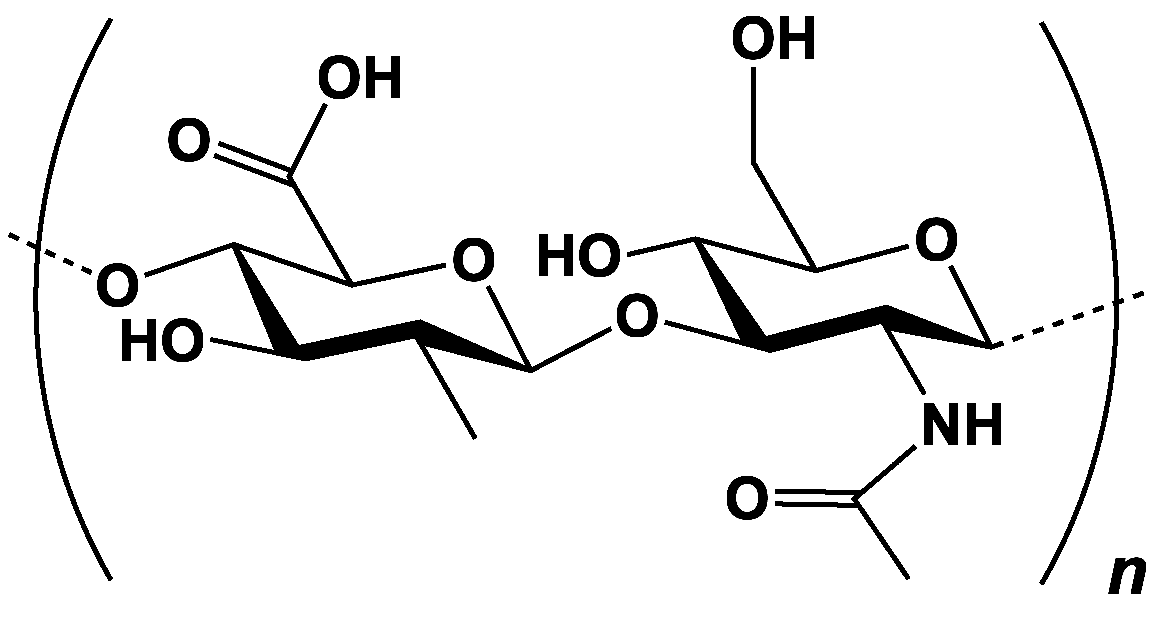
L’unité de base des GAGs est un disaccharide, constitué d’un hexose (acide hexuronique en général) lié à une hexosamine. Cette classe ubiquiste de composés a été découverte dans les tissus conjonctifs et étudiée par le biochimiste américain d’origine allemande Karl Meyer dès 1930. Avec son équipe, il a isolé les enzymes responsables de leur dégradation, d’abord dans des bactéries puis dans la salive et le venin de serpent (cf. Venins et toxines).
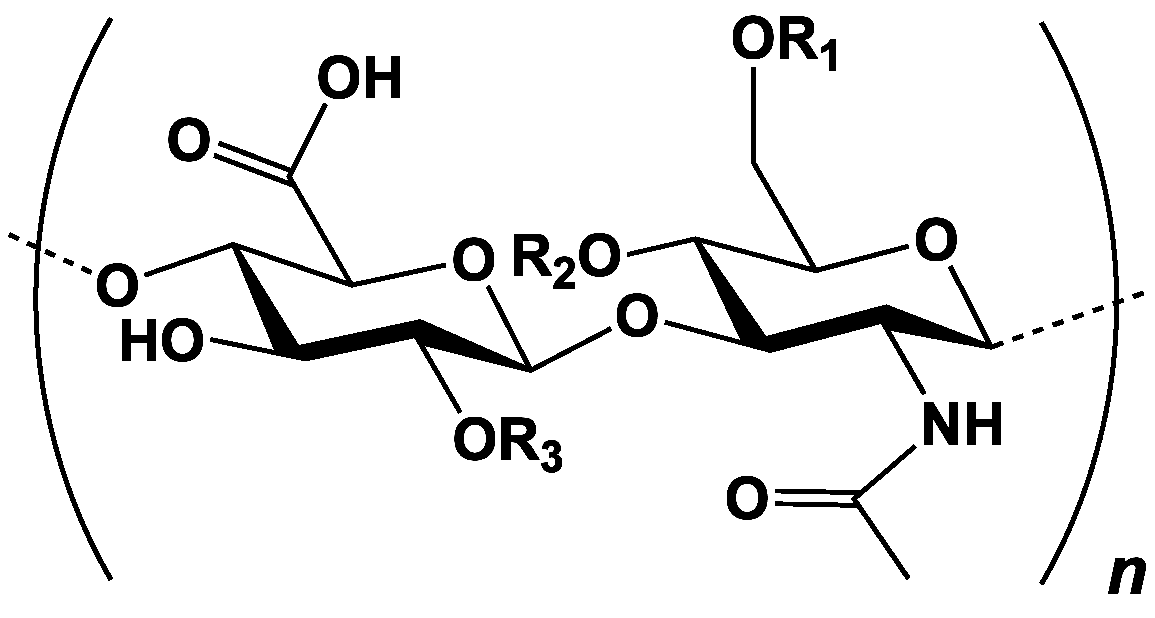
Une des caractéristiques de ces chaînes oligosaccharides est leur très grande hétérogénéité. En effet, la longueur variable des chaînes et leurs modifications structurales (sulfatations, épimérisations) conduit à un nombre de combinaisons quasi-infini ! Selon la nature des oses et la manière dont les disaccharides sont reliés entre eux, les GAGs sont classés en 5 grandes familles : les héparines (Hp) et les héparanes sulfates (HS), l’acide hyarulonique (AH), les chondroïtines sulfates (CS), les dermatanes sulfates et les kératanes sulfates (KS, plus complexes avec 3 sous-types).
La biosynthèse des GAGs et leur biodégradation (remodelage des chaînes saccharidiques permettant une activité biologique précise et/ou recyclage, dit turn-over, font intervenir de nombreux processus, aboutissant à une régulation subtile de leur concentration. Une maladie génétique rare, qui dérègle la mécanique, est la mucopolysaccharidose (MPS), provoquant des lésions cellulaires, tissulaires et organiques irréversibles.
Le plus ancien GAG connu est l’acide hyarulonique, qui tire son nom du grec hyalos (vitreux), car il a d’abord été isolé de l’humeur vitrée de l’œil, puis dans le liquide synovial dont il assure la fluidité, et la peau dont il maintient l’hydratation. Les unités disaccharide sont composées d’acide D-glucuronique et de D-N-acétylglucosamine, liées entre elles par des liaisons glycosidiques alternées β-1,4 et β-1,3. Les polymères, des gels, peuvent avoir une taille variant entre 102 et 104 kDa in vivo (soit une taille comparable à celle d’une bactérie !). C’est le seul GAG à ne pas exister sous forme sulfatée, ni liée à une protéine. Il est produit industriellement à partir de crêtes de coq, mais aussi par fermentation bactérienne.
Ses propriétés hydratantes en font un favori de l’industrie cosmétique et de la chirurgie esthétique ; mais il sert aussi en chirurgie ophtalmologique, pour traiter l’arthrose du genou… et même comme complément alimentaire pour compenser la diminution de sa concentration avec l’âge (les habitants de Yuzurihara au Japon -le « village de longue vie »- auraient la plus longue espérance de vie connue grâce à leur taux constant d’acide hyaluronique !). C’est un régulateur du fonctionnement cellulaire, très impliqué dans tous les stades de la cicatrisation.
Le GAG le plus abondant est le sulfate de chondroïtine (CS). Il est constitué d’une chaîne d’une centaine d’unités de N-acétyl-D-galactosamine (GalNAc) liée à un acide D-glucuronique (GlcA). Le groupe sulfate est lié par une liaison covalente au sucre, et son nombre et sa position sont variables dans le polymère, entraînant des propriétés biologiques variées du GAG.
La sulfatation se fait généralement par l’intermédiaire de sulfotransférases spécifiques. Les calamars, les requins, certains crustacés possèdent des CS hautement sulfatés.
Le CS est un complément diététique très largement utilisé à travers le monde par les patients atteints d’ostéoarthrite. Il serait sûr, sous réserve qu’il soit pur : importé de Chine, il s’est avéré dangereux car contaminé et non métabolisable par le cytochrome P450 (cf. Cytochrome P450). Selon les études les plus récentes, le CS montrerait bien une activité anti-inflammatoire, en inhibant la synthèse d’enzymes protéolytiques, d’oxyde nitrique (oxydes d’azote) et d’autres substances responsables de la détérioration de la matrice cartilagineuse et de la mort des chondrocytes (cellules) articulaires.
Une épimérisation en C-5 transforme le résidu GlcA en IdoA (acide L-iduronique) : c’est le cas des dermatanes sulfates et de certaines héparines. Ce sucre semble intervenir dans l’inhibition du virus responsable des bronchiolites et des pneumonies chez le jeune enfant.
|Les dermatanes sulfates, extraits de diverses algues comme {Padina pavonica, sont réputés lutter contre le vieillissement cutané (souvent en association avec l’acide hyarulonique).
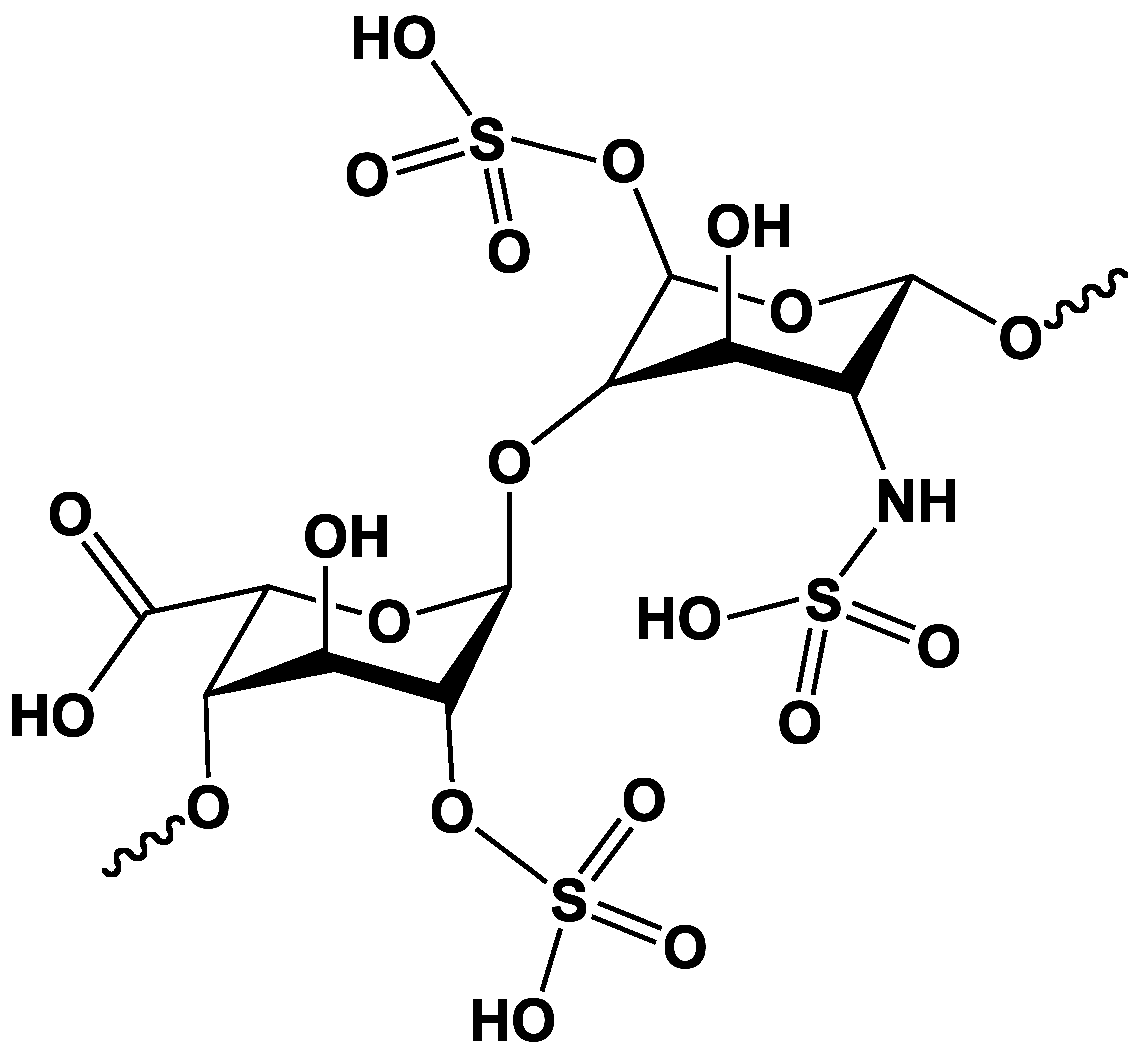
L’héparine est majoritairement composée de IdoA(2S)-(1-4)-GlcNS(6S). C’est un anticoagulant très puissant, propriété découverte dès 1916 par Mac Lean. Elle active en effet l’antithrombine, une protéine plasmatique, inhibiteur naturel des protéases impliquées dans la cascade de la coagulation. Hautement sulfatée, c’est la molécule biologique qui possède la plus haute densité connue de charges négatives. Il existe 48 possibilités de Hp et HS selon la structure du disaccharide de base Elles ne sont pas exprimées dans les mêmes cellules et n’ont pas exactement les mêmes fonctions in vivo.
Des héparines de bas poids moléculaire (HBPM) sont fabriquées par dépolymérisation chimique ou enzymatique de l’héparine (comme l’Enoxaparine®, etc.) Le Fondaparinux® (pentasaccharide) est un dérivé de synthèse donnant théoriquement moins d’accidents allergiques (thrombopénie induite par l’héparine (TIH) notamment), mais qui ne peut pas être antagonisé par la protamine, utilisée en urgence en cas de complication avec l’héparine. Les héparines sont utilisées, non seulement à titre curatif, mais également en prévention primaire quand on craint des accidents thromboemboliques, notamment lors d’alitement prolongé et en post-opératoire, malgré un risque d’ostéoporose par fuite de calcium.
Dès 1865, le Professeur Trousseau postulait un lien entre cancer, hypercoagulabilité et risque de thrombose, et un siècle et demi plus tard, il est montré que l’activation de la coagulation intervient dans l’angiogenèse tumorale et la dissémination métastatique (lors du diagnostic de maladie thromboemboliques veineuse, 20 % des patients ont un cancer).
In situ, les GAGs (sauf HA) sont généralement sous forme de protéoglycannes (ou mucopolysaccharides), c’est-à-dire liés à une protéine (core protéique), souvent par l’intermédiaire d’un trisaccharide constitué généralement de deux résidus galactose et un résidu xylose : les chaînes de GAGs s’organisent perpendiculairement au cœur protéique comme les poils d’une brosse. C’est leur ubiquité et leurs rôles physiologiques qui rendent les GAGs uniques et indispensables, comme nous le verrons dans le prochain épisode…
Pensée du jour
« Grâce aux GAGs, la vieillesse ne serait plus un naufrage, et ce n’est pas un gag… »
Sources
– http://en.wikipedia.org/wiki/Glycosaminoglycan
– http://tel.archives-ouvertes.fr/docs/00/17/11/70/PDF/These_Stephane_Sarrazin.pdf
– http://fr.wikipedia.org/wiki/Acide_hyaluronique
– http://en.wikipedia.org/wiki/Chondroitin_sulfate
– http://www.arthritis.org/cs-ha.php
– http://themedicalbiochemistrypage.org/glycans.html
– http://en.wikipedia.org/wiki/Proteoglycan
– http://fr.wikipedia.org/wiki/Héparine_de_bas_poids_moléculaire
– http://fr.wikipedia.org/wiki/Héparine
– http://en.wikipedia.org/wiki/Heparan_sulfate
– http://en.wikipedia.org/wiki/Fondaparinux
– http://fr.wikipedia.org/wiki/Enoxaparine
– http://en.wikipedia.org/wiki/Iduronic_acid
– http://en.wikipedia.org/wiki/Keratan_sulfate
– http://en.wikipedia.org/wiki/Dermatan_sulfate
– www.jle.com/fr/revues/medecine/hma/e-docs/00/04/57/BC/article.phtml
Pour en savoir plus
– Botox, biotox
– Venins & toxines
– Cytochrome P450

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie