Joseph Priestley, orphelin très jeune, et de santé fragile, fut élevé par une tante, dévote protestante, mais fréquenta des établissements scolaires qui lui apportèrent le goût de la réflexion critique. Il y apprit le grec et le latin, et durant ses vacances, apprit l’hébreu. Atteint de tuberculose avant ses 10 ans, il en profita pour apprendre, seul, le français, l’italien et l’allemand et des langues plus rares comme syrien, chaldéen et arabe. Et toujours seul, il s’initia à l’algèbre, la géométrie et autres mathématiques.
Ces plaisirs intellectuels ne l’empêchèrent pas de vouloir devenir ministre du culte, mais rebuté par l’orthodoxie calviniste professée dans la plupart des écoles auxquelles il pouvait prétendre, il choisit l’Académie de Daventry, plus libérale, qui lui offrait la possibilité d’étudier, outre les matières théologiques classiques, la science expérimentale et naturelle, qu’on appelait alors philosophie naturelle.
Dès ses premiers postes, et malgré sa courtoisie et un abord agréable, ses prêches ne lui attirèrent pas la sympathie de ses ouailles, et il se tourna rapidement vers ce qui l’intéressait le plus, l’éducation, où il brilla tout au long de sa vie, écrivant et publiant de multiples ouvrages sur le sujet. Son influence fut grande très tôt : il ouvrit à ses étudiants des perspectives nouvelles et audacieuses en histoire, politique, œuvres de poètes comme Milton et d’écrivains classiques et de son temps.

Pour illustrer ses écrits, il apprit le dessin et la gravure sur cuivre, et découvrit à cette occasion, un usage nouveau de la gomme indienne : effacer la mine de plomb des crayons.
Les circonstances l’amenèrent à faire preuve d’une grande mobilité géographique, en Angleterre puis aux États-Unis, où il se lia d’amitié avec le Président Thomas Jefferson. Au hasard de ses rencontres et de ses lectures, il se passionna pour l’optique, la théologie, la politique… et la chimie. Il bénéficia des largesses de mécènes capables de lui offrir laboratoire et équipements, comme le Duc de Shelburne, et eut à gérer les problèmes créés par ses choix politiques, philosophiques et théologiques (on ne lui accorda pas la possibilité, qu’il sollicitait, d’accompagner le capitaine Cook à cause de ses opinions religieuses).
C’est entre 1773 et 1780 qu’il produisit deux de ses ouvrages parmi les plus importants, « Disquisitions Relating to Matter and Spirit », une vision de l’Homme nettement matérialiste, et ses « Experiments and Observations on Different Kinds of Air, and Other Branches of Natural Philosophy », en plusieurs volumes, qui relatent ses découvertes chimiques les plus significatives. Il y évoque les propriétés des acides minéraux, s’intéresse à la photosynthèse, définit le rôle du sang dans la respiration…
La pneumatique (de pneuma : respirer) et le phlogistique
Jean-Baptiste van Helmont, solitaire, mystique et peu commode (il refusa son diplôme de l’Université de Louvain, affirmant qu’il n’avait rien appris !), fut le premier à la fin du XVIe siècle, à mettre en évidence la conservation de la masse lors de la combustion du charbon et l’existence de différents « esprits de l’air », deux esprits de bois (dioxyde de carbone et monoxyde de carbone) et le gaz pinque (méthane).
Au XVIIe siècle, les gaz comme substances chimiques obtinrent droit de cité et ouvrirent la chimie à des perspectives nouvelles. Les expériences d’Evangelista Toricelli en 1644 (le baromètre), et de Otto von Guericke en 1654 (la sphère de Magdebourg) démontrent l’existence du vide, et a contrario de l’air. Robert Boyle « chymiste » sceptique et passionné, père de la chimie scientifique, montra que « {lorsque l’air commun est réduit à la moitié de sa mesure coutumière, il acquiert un ressort presque deux fois plus puissant qu’il avait auparavant » (p1V1 = p2V2 : loi de Boyle, 1662, et de Mariotte, 1666).
La pneumatique devint à la mode, et de nombreux nouveaux gaz se mirent à être découverts, à la suite notamment de Henry Cavendish, lui aussi physicien et chimiste, et de son mémoire « On Factitious Airs » de 1766. Mais le plus prolifique, le recordman, fut Joseph Priestley avec 8 nouveaux gaz !
En 1767, Priestley et sa famille allèrent s’installer à Leeds, par hasard à côté d’une brasserie (lieu d’inspiration scientifique efficace aussi pour Joseph Black et ses travaux sur la chaleur). On savait bien sûr que durant la fermentation des bulles apparaissaient, remontaient le liquide jusqu’à sa surface et formaient une couche plus ou moins mousseuse. Il profita de la quantité illimitée de matériel disponible pour étudier le phénomène. Il montrera que ce « nouvel air » était identique à « l’air fixe » de Joseph Black découvert vers 1754, une des expériences qui permit de réfuter la théorie du phlogistique, à laquelle Priestley ne renonça jamais.
Mais toujours pratique, il lui vint l’idée de créer le même type d’effervescence artificiellement, en utilisant ce gaz (du dioxyde de carbone, cf. Dioxyde de carbone) à disposition, et, en 1772, il inventa l’eau gazeuse, en dissolvant sous pression le gaz récupéré. Pour cela, il perfectionna la cuve pneumatique inventée par Stephen Hales (une cuve renversée remplie d’eau) en remplaçant l’eau dans laquelle ce gaz était soluble, par du mercure.
Cette même année 1772, il met en évidence les vapeurs nitreuses (NO2, cf. Oxydes d’azote), l’air nitreux diminué (N2O, cf. Protoxyde d’azote), l’air acide (HCl, cf. Acide chlorhydrique), et l’air inflammable (CO, cf. Monoxyde de carbone). En 1773, ce sera l’air alcalin (NH3, cf. Ammoniac) Oxydes d’azote ; en 1774, l’air vitriolique (SO2, cf. Acide sulfurique) et en 1775, l’air fluoré.
Mais c’est sa découverte de l’air déphlogistiqué qui fera à la fois sa gloire et son malheur. Le 1er août 1772, il prépare en effet un gaz nouveau, dont il ne cherchera pas la structure précise, le dioxygène (cf. Dioxygène) par décomposition thermique de mercurius calcinatus per se rouge (HgO). Pour fournir la chaleur nécessaire, il utilisa une lentille de 30 cm de diamètre pour focaliser les rayons du soleil sur l’échantillon, conduisant à la réaction :
HgO(s) ———> Hg(l) + O2(g)
Il observe que le gaz produit, incolore et inodore, rend les flammes extrêmement vives. Des essais complémentaires lui montreront que cet air est meilleur que l’air commun, ce qu’il décrit avec un certain lyrisme « {[My] breast felt particularly light and easy for some time afterwards… Who can tell, but that, in time, this pure air may become a fashionable article of luxury. Hitherto only two mice and myself have had the privilege of breathing it ».
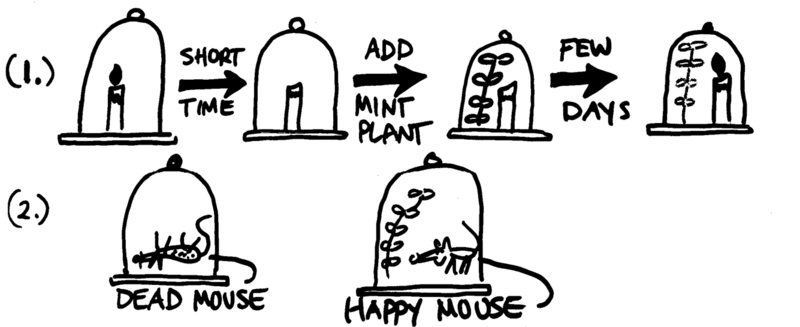
Il fit d’ailleurs quelques expériences, montrant que des souris peuvent vivre plus longtemps sous une cloche fermée contenant des végétaux, que sous une cloche qui n’en contient pas. Il observa ainsi l’existence de la photosynthèse, et le phénomène de respiration.
A l’occasion d’un voyage à Paris en 1774, Priestley rencontre Antoine-Laurent Lavoisier (cf. Lavoisier), à qui il montre ses travaux et notamment l’isolement d’un nouveau gaz, qu’il appelle air déphlogistiqué. En pratiquant ses propres expériences avec ce nouveau gaz, Lavoisier comprend qu’il est en présence du principe même qui commande des phénomènes encore mal expliqués, comme, entre autres, la combustion et la respiration. Il appellera d’abord ce gaz « air éminemment respirable » quand il observera qu’il est présent dans l’atmosphère et nécessaire à la vie des animaux. En 1777, Il présente une nouvelle « théorie générale de la combustion » pour remplacer le phlogistique, et donne le nom d’oxygène (source d’acide, en grec) au nouveau gaz.
La rigueur du travail de Lavoisier, les arguments qui en découlent, amenèrent à terme l’ensemble de la communauté scientifique à répudier la théorie du phlogistique, et sonna le triomphe de la méthode scientifique. Cependant, tout esprit supérieur qu’il fut, Lavoisier défendit un hypothétique principe de chaleur, qu’il appela le calorique, nouvel avatar, ni gaz ni liquide, impondérable, du feu élémentaire des alchimistes. Selon un de ses proches, Henri Mercereau, ses savants collègues, quoique laudatifs avant et après sa mort, ne tentèrent pas d’empêcher sa décapitation, voulue en particulier par Marat (dont il avait bloqué la candidature à l’Académie des Sciences).
Dans sa correspondance, Lavoisier dit à plusieurs reprises ce qu’il doit à Priestley. Par contre, il n’est pas fait mention de Carl Scheele, apothicaire suédois, qui avait également séparé le dioxygène en 1772 (mais la publication de ses résultats dans son livre Traité chimique de l’air et du feu fut retardée grâce à son mentor le Professeur Torbern Bergman dont il attendit la préface promise durant 4 longues années).
Quant à Joseph Priestley, malgré son esprit anti-conformiste, si vif en politique et en religion, il refusa jusqu’à sa mort de reconnaître son erreur, en s’appuyant sur l’augmentation ou la perte de masse lors de la combustion, dont la responsabilité revenait, selon lui, à l’absorption ou l’expulsion de phlogistique. En vérité, il semble bien que Priestley ait été à la recherche d’une vision unitaire du monde et que le phlogistique, notion à tout faire lui convenait bien, alors que la théorie de Lavoisier fragmentait le monde de la matière en entités multiples, le rendant plus chaotique.
On était loin à l’époque de la prise de conscience de la complexité comme réalité, de la notion de multi-échelles, que nous devons affronter quotidiennement.
Pic de la Mirandole et le savoir universel possédé par un homme n’était pas si loin, et nous avons plus récemment savouré notre E = {mc2 comme clé de la compréhension de l’univers… En fait, tous les travaux de Priestley montrent qu’il ne manquait pas d’une certaine candeur (vraie ou fausse, les historiens ne s’accordent pas sur ce point), au moins en science qu’il pratiqua en autodidacte. Il avait cependant lu les fondamentaux de l’époque, notamment le livre de chimie de Boerhaave en 1755, et assisté aux cours et expériences du physico-chimiste Matthew Turner à l’Académie de Warrington. Ses documents, correspondances et même livres scientifiques fourmillent de notes et commentaires sans aucun rapport avec le sujet, ce qui reflète le fait que ses principales préoccupations allaient vers sa réflexion philosophique, la gouvernance, le combat contre les Eglises accusées de tous les maux (voir ses livres « An History of the Corruptions of Christianity et Institutes of Natural and Revealed Religion » en 3 volumes (1772–74).
Il prit avec vigueur le parti de la Révolution Française, de la Guerre d’Indépendance américaine par livres, pamphlets, conférences publiques, etc. Il se fit tellement d’ennemis par la violence de ses diatribes qu’il dut fuir Birmingham pour Londres en 1791, après une émeute plus ou moins téléguidée par les autorités locales, le jour du 2ème anniversaire de la prise de la Bastille : l’Angleterre était viscéralement antirévolutionnaire, son laboratoire fut ravagé et sa maison incendiée.
La vie devint de plus en plus difficile : Priestley, en compagnie de Thomas Paine, est brûlé en effigie ; de perfides caricatures politiques n’ont de cesse de l’accabler, des lettres lui sont envoyées de partout, le comparant au diable ; les commerçants en viennent à craindre de traiter avec la famille, et même ses collègues et amis de la Royal Academy prennent leur distance. Devant l’alourdissement des sanctions requises à l’encontre des opposants, et malgré son élection à la Convention nationale française indépendamment par trois départements en 1792, Priestley décide d’émigrer en Amérique avec sa famille, où il refusera un poste de professeur de chimie à l’Université de Philadelphie.
Cinq semaines après son départ, le gouvernement de William Pitt commence à arrêter des radicaux pour « calomnie séditieuse », avant que ne débute le célèbre procès pour trahison de 1794.
Priestley et sa famille s’installent en 1794. Il subit là encore la hargne de ses opposants, est accusé de fomenter une révolution ; la maladie atteint ses proches, puis lui-même en 1801 et il meurt le 6 février 1804 dans la petite ville de Northumberland, où il est enterré.
Kant en 1781, exprime son admiration pour Priestley dans sa Critique de la Raison Pure, et Georges Cuvier, dans un émouvant éloge, le qualifie de « {père de la chimie moderne qui n’a jamais voulu reconnaître sa fille »
Des statues de Joseph Priestley sont érigées, son nom est donné à de nombreux collèges et institutions scientifiques, et l’American Chemical Society le choisit pour sa plus prestigieuse distinction, et organiser des réunions solennelles dans la dernière maison qu’il a habitée.
Comme aujourd’hui, politique et science étaient souvent mêlés. Priestley polémiste infatigable, aurait-il été un précurseur de l’écologie ? D’où, extrait de son œuvre, la …
Pensée du jour
« The injury which is continually done to the atmosphere by the respiration of such a large number of animals…is, in part at least, repaired by the vegetable creation »
Sources
– www.newworldencyclopedia.org/entry/Joseph_Priestley
– J. Priestley, Autobiography of Joseph Priestley with an introduction by J. Lindsay, – Associated University Presses, Cranbury, New Jersey, 1970.
– D.J. Rhees, {Joseph Priestley, Enlightened Chemist, American Chemical Society, Center for History of Chemistry, Publication No. 1, 1983.
– Joël Levy, Ed., {Petit Précis de Chimie à déguster, Belin, 2011, pour la traduction française (David Carrière)
– www.encyclopedia.com/topic/Joseph_Priestley.aspx
– http://en.wikipedia.org/wiki/Joseph_Priestley
– http://mattson.creighton.edu/History_Gas_Chemistry/Priestley.html
– http://fr.wikipedia.org/wiki/Henry_Cavendish
– H. Mercereau, Lavoisier, Bibliothèque scientifique des Écoles et des Familles, N° 6, Henri Gautier Ed.
– http://fr.wikipedia.org/wiki/Liste_des_oeuvres_de_Joseph_Priestley
– www.josephpriestley.com/index.html
– http://fr.wikipedia.org/wiki/Joseph_Priestley_House
Pour en savoir plus
– Dioxyde de carbone
– Oxydes d’azote
– Protoxyde d’azote
– Acide chlorhydrique
– Monoxyde de carbone
– Ammoniac
– Acide sulfurique
– Lavoisier

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie