Le phénol, sous le nom d’acide carbolique, a été isolé à l’état pur en 1834 à partir du goudron de houille, qui est resté la source primaire jusqu’au développement de l’industrie pétrochimique qui en permit des synthèses de plus en plus économiques. Pur, il se présente à la température ordinaire comme un solide blanc cristallisé. C’est un composé toxique (VME = 19 mg/m3) qui provoque des brûlures graves sur la peau.
Ses solutions («l’acide phénique ») ont été parmi les premiers antiseptiques utilisés en médecine : Sir Joseph Lister, dans ses travaux séminaux en chirurgie antiseptique, préconise le nettoyage complet des blessures avant de les recouvrir d’un morceau de tissu imprégné d’une solution de phénol.
L’énergie de résonance du phénol est évaluée à 167 kJ/mol et est donc plus élevée que celle du benzène (150 kJ/mol). Ce résultat peut s’expliquer par la participation d’un doublet non liant de l’atome d’oxygène à la résonance. La structure du phénol déterminée par radiocristallographie montre une molécule plane et un raccourcissement de la longueur de la liaison C–O. L’augmentation de l’énergie de cette liaison par rapport à celle d’un alcool comme le cyclohexanol confirme cette contribution à la délocalisation électronique.
L’importance grandissante du phénol comme précurseur de molécules actives (médicaments, pesticides, arômes, etc.) et comme composant de certaines résines comme la bakélite (cf. Méthanal) a conduit au développement de nombreux procédés, dont le plus ancien, remontant à 1889 consistait à effectuer la fusion alcaline du phénylsulfonate de sodium :
C6H5SO3Na + NaOH ———> C6H5OH + Na2SO4
Le procédé actuel, introduit dans les années 50, consiste en l’oxydation de l’isopropylbenzène (cumène) par l’oxygène de l’air (procédé Hock). Le sous-produit de la réaction est l’acétone qui est notamment utilisé comme solvant. Ce procédé illustre, bien avant la lettre, le concept d’économie d’atomes, une des caractéristiques de la « chimie pour le développement durable » : limiter le coût des réactifs et valoriser au maximum les sous-produits. Le cumène est lui même obtenu en associant dans une réaction de Friedel-Crafts (cf. Charles Friedel) deux des briques de la pétrochimie : le benzène et le propylène (cf. Propylène).
L’oxydation du benzène a été également étudiée, car elle éviterait la production d’acétone dont le débouché en tant que solvant est maintenant limité du fait de sa grande volatilité. L’oxydation directe par l’oxygène de l’air a été décrite, mais le procédé le plus intéressant emploierait dans un processus catalytique le protoxyde d’azote (cf. Protoxyde d’azote), formé lors de la préparation du nylon-6,6 (cf. Nylon), puisque le sous-produit ne serait autre que l’azote : C6H6 + N2O ———> C6H5OH + N2
La production mondiale de phénol est actuellement d’environ 9 Mt/an. La majeure partie du phénol est employée pour l’élaboration de matériaux plastiques ou leurs précurseurs :
– la condensation avec le méthanal conduit aux résines phénoliques dont la fameuse Bakélite,
– la condensation avec l’acétone fournit le bisphénol A (cf. BisphénolA), un des constituants des polycarbonates,
– l’hydrogénation catalytique du phénol conduit à la cyclohexanone et au cyclohexanol, intermédiaire dans la préparation de l’acide adipique en un des constituant du nylon-6,6,
– l’alkylation du phénol par des halogénures d’alkyle à longue chaîne conduit à des précurseurs de détergents non ioniques.
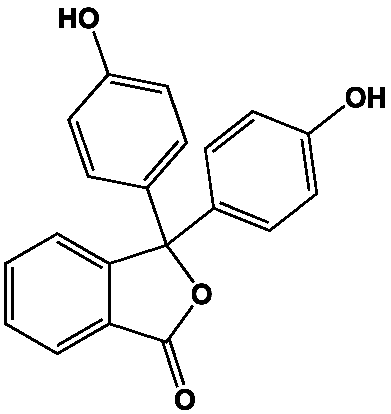
Le phénol est aussi le précurseur de très nombreuses molécules actives (médicaments, pesticides, herbicides, etc.) dont la plus célèbre est l’aspirine (cf. Aspirine). N’oublions pas la phénolphtaléine, produit de la condensation de l’anhydride phtalique avec deux molécules de phénol, indicateur coloré très largement utilisé dans les dosages acido-basiques. Sa zone de virage (de l’incolore au rose) est comprise entre pH 8,2 et 10.
Dans un registre plus sombre, ce fut un produit employé dans les camps de concentration, notamment Auschwitz-Birkenau : l’injection intraveineuse d’un gramme de phénol, voire directement dans le cœur, suffit pour entrainer la mort. Une solution espérée plus économique par les nazis que le zyklon B »…
Mais terminons sur une note plus plaisante : le phénol est un composant mesurable dans l’arôme et le goût distinctifs du whisky d’Islay, qui en contient généralement 30, mais jusqu’à 100 ppm, d’où la
Pensée du jour
«À la publicité pour le Pure Malt, 45° GL, avec la mention : « l’abus de phénol est dangereux pour la santé ?»
Sources
– http://fr.wikipedia.org/wiki/Phénol_(molécule)
– http://fr.wikipedia.org/wiki/Phénol_(groupe)
– www.faidherbe.org/site/cours/dupuis/phenolsd.htm
– www.societechimiquedefrance.fr/extras/Donnees/orga/cumene/cadcum.htm
– www.inrs.fr/htm/frame_constr.html?frame=http%3A%2F%2F
– www.inrs.fr%2Finrs-pub
– http://en.wikipedia.org/wiki/Phenol
Pour en savoir plus
– Benzène
– Styrène
– Lignine
– Vanilline/Vanille
– Méthanal
– Charles Friedel
– Propylène
– Protoxyde d’azote
– Bisphénol A
– Nylon
– Aspirine

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie