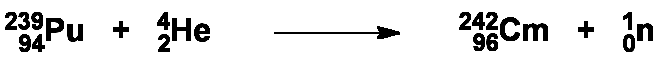Différents traitements acides et basiques ont permis de séparer deux isotopes de cet élément, le bombardement engendrant également la formation d’isotopes de l’américium dont la séparation s’est avérée si difficile que ces deux éléments furent d’abord baptisés {pandemonium (du Grec, pour enfer) et {delirium (du Latin, pour folie). L’isotope 242Cm est issu d’une réaction appelée (α,n) : capture d’une particule α et émission d’un neutron :
Le curium, élément 96 et quatrième actinide artificiel, fut breveté par GlennT. Seaborg. La première quantité pondérable de curium a été obtenue en 1947 par Louis B. Werner et Isadore Perlman sous forme d’hydroxyde de Cm(III) : 40 μg d’hydroxyde 242Cm(OH)3, issus de l’irradiation neutronique d’américium 241Am. Ce n’est qu’en 1951 qu’il a été préparé à l’état élémentaire par réduction du fluorure de curium(III) CmF3 par du baryum.
Chaque tonne de combustible nucléaire électrogène irradié en contient une vingtaine de grammes, issus principalement des réactions du 239Pu avec des neutrons selon des réactions (n,γ) alternant avec des émissions β– :
Le curium présent dans l’environnement provient pour la plus grande part des essais nucléaires atmosphériques, jusqu’en 1980. Il faut noter, encore un « secret Défense » levé en 1956, que dans les déchets de la première bombe H américaine du 1er novembre 1952 sur l’atoll d’Eniwetok, outre la première détection d’einsteinium et de fermium, on a trouvé à côté du plutonium et de l’américium des isotopes du curium, du berkélium et du californium. Le curium a été identifié par ses isotopes 245Cm et 246Cm et, en plus petites quantités, 247Cm et 248Cm.
Vingt radio-isotopes et 7 nucléides isomères, entre 233Cm et 252Cm, sont connus pour le curium qui n’a pas d’isotopes stables. Les plus longues demi-vies ont été rapportées pour 247Cm (15,6 millions années) et 248Cm (348 000 années). D’autres isotopes à longue durée de vie sont 245Cm (demi-vie de 8 500 ans), 250Cm (8 300 ans) et 246Cm (4 760 ans). Les isotopes les plus généralement sont 242Cm et 244Cm avec les demi-vies de 162,8 jours et de 18,1 ans, respectivement. Tous les isotopes entre 242Cm et 248Cm subissent une réaction en chaîne nucléaire auto-entretenue et en principe peuvent être des combustibles nucléaires dans un réacteur, mais sans avenir pour la production d’électricité à grande échelle, sachant que l’on estime le gramme de 242Cm à 1 450 € et le gramme de 244Cm à 125 € : rappelons que le gramme de rhodium (cf. Rhodium) est de l’ordre de 250 €!
Par contre, ces deux isotopes, avec de courtes demi-vies (respectivement 162,8 jours et 18,1 ans), possèdent des énergies de rayonnement α de l’ordre de 6 MeV, bien plus élevées que le radium-226, engendré dans la chaîne de désintégration naturelle uranium-radium et qui a une demi-vie de 1 600 ans. Cette radioactivité engendre une grande quantité de chaleur : le 244Cm émet 3 W/g, et le 242Cm jusqu’à 120 W/g. En raison de cette très grande émission de chaleur, ils pourraient être utilisés dans des générateurs thermoélectriques à radio-isotopes, sous la forme d’oxyde de curium(III), Cm2O3, pour l’alimentation en énergie électrique de sondes spatiales. Toutefois, il leur est préféré le plutonium-238 (cf. Plutonium).

Mais pourquoi le nom de curium a-t-il été choisi par les découvreurs de cet élément ? En fait, le curium est le 8ème actinide, comme le gadolinium est le 8ème lanthanide (cf. Lanthanides) : il se trouve ainsi dans la classification périodique juste en-dessous du gadolinium qui doit son nom au chercheur sur les terres rares finlandais, Johan Gadolin. Le choix de ce nom par Glenn T. Seaborg fut fait en l’honneur de Pierre et Marie Curie, dont les travaux ont ouvert la voie aux recherches sur la radioactivité :
« {Comme nom pour l’élément de numéro atomique 96, nous aimerions proposer « curium », avec le symbole Cm. Il y a des preuves que l’élément 96 contient 7 électrons 5f, et est donc analogue à l’élément gadolinium avec ses 7 électrons 4f de la série des terres rares. Sur cette base, l’élément 96 serait nommé d’après les Curie, de manière analogue à la désignation du gadolinium, en l’honneur du chimiste Gadolin ».
Pensée du jour
«Curium, partie irradiante de la famille aux six Prix Nobel.»
Sources
– http://fr.wikipedia.org/wiki/Curium
– http://en.wikipedia.org/wiki/Curium
– www.webelements.com/curium/
– www.periodicvideos.com/videos/096.htm
Pour en savoir plus
– Plutonium
– Rhodium
– Sulfates de fer
– Lanthanides

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie