Le concept d’allélopathie a été proposé en 1937 par Hans Molisch, puis en 1984 par Elroy Leon Rice dans une monographie fondatrice. Plus de 30 000 composés allélochimiques sont maintenant connus ! Certains sont très simples, comme l’acide salicylique (cf. Aspirine) ou l’acide jasmonique (cf. Limonènes et Monoterpènes), impliqués dans les voies de défense des plantes contre leurs prédateurs, insectes ou micro-organismes, l’élicitation.
Les relations des végétaux avec les micro-organismes ne sont pas toujours conflictuelles. Certaines sont des symbiotes tout aussi complexes que les relations entre agents pathogènes et plantes, aux conséquences tout aussi importantes pour l’agriculture. Il existe d’ailleurs des ressemblances de structure et de fonction entre le parasitisme et la symbiose. Certains parasites peuvent devenir symbiotes et inversement selon l’environnement, l’état physiologique du végétal et la variabilité génétique des protagonistes !

La première étape du processus de reconnaissance entre symbiotes et hôtes résulte d’un dialogue chimique entre les protagonistes via des signaux moléculaires, des flavonoïdes capables d’attirer le microorganisme vers la plante émettrice.
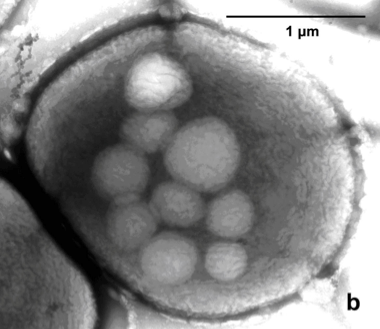
Chez les légumineuses, la séquence des évènements débutent par l’infection par des bactéries aérobies du sol de type Rhizobium et se termine par la formation d’un nodule différencié fixant l’azote. Globalement, le processus met en jeu des interactions multiples et à diverses étapes : les Rhizobiums et les racines du futur hôte nouent un dialogue sous la forme de messages chimiques.
L’étape précoce est l’attraction des bactéries par les exsudats racinaires des plantes hôtes, chimiotactisme positif et spécifique du futur couple symbiotique. Après avoir colonisé la rhizosphère, les Rhizobiums commencent à synthétiser des signaux moléculaires appelés facteurs de nodulation, ou {facteurs Nod. Sécrétés dans la solution du sol par les {Rhizobiums, ils déclenchent dans les poils absorbants des réponses moléculaires et cellulaires qui sont nécessaires à l’infection ultérieure par {Rhizobium, puis le développement du nodule.
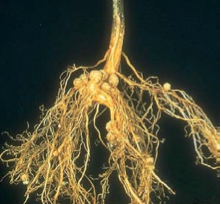
Le processus infectieux dure toute la vie du nodule, sa taille augmente, les bactéries continuent à envahir les nouvelles cellules formées. À maturité, des connexions vasculaires s’établissent qui font des nodosités de véritables organes d’échange métabolique, à bénéfice réciproque, énergie contre azote assimilable.
L’un des problèmes les plus cruciaux auxquels les organismes fixateurs d’azote doivent faire face est la sensibilité (inhibition irréversible) des nitrogénases au dioxygène moléculaire O2. Or, les grandes quantités d’énergie requises (sous la forme d’ATP et de réducteurs) sont produites dans la chaîne respiratoire cellulaire qui ne fonctionne efficacement qu’en présence de dioxygène ! La formation d’hétérocystes (du grec heteros, différent, et cystis, sac), kystes ou nodules, peut être une réponse à cette contradiction.
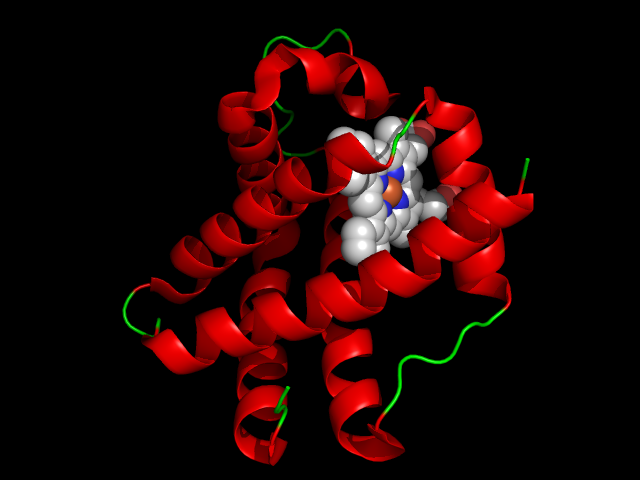
Dans les nodules des légumineuses, la concentration en dioxygène est régulée en grande partie par une hémoprotéine, dont la structure et la propriété de transporteur de dioxygène sont proches de celles de notre hémoglobine (cf. Hémoglobine) quoique de masse moléculaire quatre fois plus faible : la léghémoglobine (ou LegHb). Synthétisée par la plante hôte, elle est localisée dans les cellules infectées par les bactéroïdes, où elle maintient une concentration qui permet à la fois leur respiration et la production d’ATP et de réducteurs, et empêche l’inactivation des nitrogénases. Elle peut constituer jusqu’à 30 % des protéines de la cellule hôte et confère au nodule sa couleur rose.
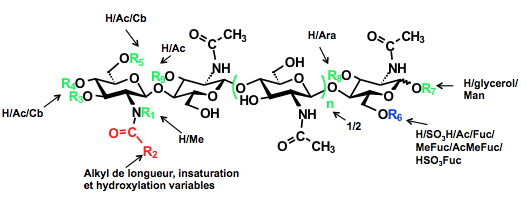
Les facteurs de nodulation sont des composés chimiques complexes, des lipo-chitooligosaccharides ou LCOs, qui vont déclencher chez la plante le programme d’organogenèse conduisant à la formation du nodule. La nature structurale des signaux moléculaires et les mécanismes impliqués ont été découverts par le français Jean Dénarié et ses collaborateurs. Ces molécules sont des oligomères de sucres (4 ou 5 sucres) substitués par une chaîne lipidique et couplés à une chitine (cf. Chitine-chitosane). La présence de chitine dans ces composés est {a priori surprenante, car ni les légumineuses, ni les bactéries n’en fabriquent pour leurs besoins propres ! Cette structure pourrait être un «emprunt» fait par les associations Rhizobium-légumineuses à un autre système, beaucoup plus ancien dans l’évolution, la symbiose entre les champignons endo-mycorhiziens et les plantes.
D’autres associations, comme les symbioses mycorhiziennes (du grec myco, champignon et rhiza, racine), concernent 95 % des espèces végétales et se rencontrent dans tous les écosystèmes, chez les plantes ligneuses comme chez les plantes de grande culture. Elles sont importantes pour la nutrition phosphatée et hydrique des plantes. En retour, la plante fournit aux champignons des composés organiques issus de la photosynthèse. L’idée de mécanisme proches de ceux de la nodulation est d’autant plus tentante à cause de la présence de chitine dans les facteurs Nod. Effectivement, des facteurs Myc, également des LOCs, viennent d’être isolés et caractérisés, ce qui confirme la proximité évolutive de ces deux types de symbioses pourtant fort différentes.
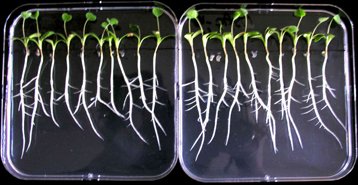
Les facteurs Nod et Myc ont, entre autres, la propriété de stimuler le développement du système racinaire qui prépare la formation respectivement de nodules et d’endomychorhyzes. Les perspectives agronomiques sont immenses. Par exemple, le traitement des graines par des concentrations faibles de facteurs Nod (0,1 mg suffit pour traiter les semences nécessaires pour un hectare !) entraîne une stimulation de la formation des nodosités fixatrices d’azote et l’augmentation des rendements pour le soja, l’arachide, le pois et la luzerne.
En 2011, les inoculants de Rhizobiums enrichis en facteurs Nod sont désormais utilisés sur 2 millions d’hectare en Argentine et aux Etats-Unis principalement, entraînant une consommation significativement moindre d’engrais azotés.
Pensée du jour :
«La communication chimique entre plantes et microorganismes pour sauver la planète de la faim ?»
Sources :
– http://fr.wikipedia.org/wiki/Allélopathie
– E. L. Rice, {Allelopathy, énd Edition, Academic Press, 1984.
– http://duchampalatable.inist.fr/spip.php?article14
– http://fr.wikipedia.org/wiki/Rhizobium
– www.sb-roscoff.fr/ETSymbioses2008/pdf/Biofutur/30-33-Gough298.pdf
– http://fr.wikipedia.org/wiki/Azotobacter
– L.M.S Lery, M. Bitar, M.G.S Costa, S.C.S. Rössle, P.M. Bisch, {BMC Genomics 2010, 11(Suppl 5), S7.
– www.ebiologie.fr/doc-cours-cours-de-physiologie-vegetale-ii-157.html
– M.A.Santana, K. Pihakaski-Maunsbach, N. Sandal, K.A. Marcker, A.G. Smith, {Evidence that the plant host synthesizes the heme moiety of leghemoglobin in root nodules, Plant Physiol. 1998, 116(4), 1259-1269.
– http://rstb.royalsocietypublishing.org/content/361/1474/1787.abstract
– http://en.wikipedia.org/wiki/Alkaline-spring_hypothesis#Proto-ecological_systems
– www.inra.fr/lauriers/2007/jean_denarie
– http://www2.toulouse.inra.fr
– F. Maillet, V. Poinsot, O. André, V. Puech-Pagès, Al. Haouy, M. Gueunier, L. Cromer, D. Giraudet, D. Formey, A. Niebel, E.A. Martinez, H. Driguez, G. Bécard, J. Dénarié, {Nature, 2011, 496, 58-64.
– www.science.gouv.fr//
– www.sciences.upsud.fr
Pour en savoir plus :
– Aspirine
– Limonènes et Monoterpènes
– Nitrogénases
– Hémoglobine
– Chitine-chitosane

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie