Le dioxyde de carbone, ou gaz carbonique, est une molécule présentant la structure linéaire O=C=O. Ce fut, avec la vapeur d’eau, l’un des premiers gaz à avoir été décrit comme étant une substance distincte de l’air. Observé au XVIIe siècle, il fut étudié vers 1750 par l’écossais Joseph Black qui décrivit son obtention à partir de la craie par chauffage ou réaction avec la célèbre « huile de vitriol ». Plus dense que l’air, cet « air figé » ne pouvait ni entretenir une flamme, ni la vie d’un animal. C’est Antoine Lavoisier qui démontra que le dioxyde de carbone est le produit de la combustion du carbone avec le dioxygène.
Pour la petite histoire, en 1772, Joseph Priestley (le monde est petit !) força la dissolution de ce gaz dans un bol d’eau. Il venait d’inventer l’eau gazeuse, invention reprise par un certain Johann Jacob Schweppe qui fonda à Londres en 1790 une usine de production de soda connue sous le nom de… Schweppes !
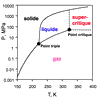
Il est soluble dans l’eau et engendre l’acide carbonique (d’où également son nom d’« anhydride carbonique ») qui se décompose facilement en eau et dioxyde de carbone. En revanche, lorsqu’il est dissous dans une solution aqueuse basique (soude, potasse…), la base retire un proton de l’acide pour former un ion hydrogénocarbonate (HCO3–), aussi appelé ion bicarbonate, puis un ion carbonate (CO32–) : la solubilité du dioxyde de carbone est ainsi considérablement augmentée.
Bien que présent à l’état de traces dans l’atmosphère (moins de 0,04 %, représentant tout de même 3 000 Gt), le dioxyde de carbone est 50 fois plus abondant dans les océans sous ces différentes formes. S’il est également éjecté lors d’éruptions d’origine volcanique (l’image de la cartouche montre un geyser sous-marin de CO2), parfois catastrophiques comme ce qui s’est produit en 1986 au lac de Nyos, les sources actuellement employées sont des gisement exploités comme les puits de pétrole ou de gaz naturel.
Le dioxyde de carbone est utilisé par les végétaux pour produire de la biomasse grâce à la photosynthèse, processus complexe consistant à réduire le dioxyde de carbone par l’eau en libérant de l’oxygène afin de produire des oses selon le cycle de Calvin grâce à l’énergie lumineuse reçue du Soleil et captée par la chlorophylle. Il est également libéré, à travers la chaîne respiratoire qui consiste à oxyder les lipides et les glucides en eau et dioxyde de carbone grâce à l’oxygène de l’air afin de produire de l’énergie. Le dioxyde de carbone est par conséquent un élément fondamental du cycle du carbone sur notre planète.
Le dioxyde de carbone a beaucoup d’autres utilisations liées à ses propriétés physicochimiques : boissons gazeuses –la plus célèbre étant le champagne qui en contient 5 L par bouteille de 0,75 L, agent de réfrigération, de congélation ou de conservation avec la glace carbonique, agent de prévention et de lutte contre l’incendie, solvant « vert » dans son état supercritique –c’est le café décaféiné, mais aussi chimiques comme source de carbone : synthèse du méthanol, des carbonates et polycarbonates –les galettes des disques compacts ou DVD, de l’urée délivrant l’azote assimilable par les plantes, etc.
Le dioxyde de carbone est un gaz à effet de serre : transparent en lumière visible mais absorbant dans le domaine infrarouge, de sorte qu’il tend à bloquer la réémission vers l’espace de l’énergie thermique reçue au sol sous l’effet du rayonnement solaire. Il est responsable de 26 % de l’effet de serre, la vapeur d’eau en assurant 60 %. L’augmentation de sa concentration depuis le début de l’ère industrielle (environ 35 %) serait en partie responsable du changement climatique constaté à l’échelle de notre planète. Les émissions de CO2 dues aux activités humaines sont surtout produites lors de la combustion de matières fossiles : production d’électricité, transports, transformation industrielle, bâtiments résidentiels et commerciaux. La fabrication du ciment, la production d’hydrogène et d’autres procédés industriels rejettent du CO2, tout comme la combustion de biomasse. Cette production anthropique, de l’ordre de 25 Gt/an, ne peut plus être absorbée par le cycle actuel du carbone : des solutions envisagées pour son piégeage et son stockage sont à l’étude, avec quelques résultats encourageants, mais qui représentent un coût non négligeable.
Il faut noter qu’il y a 500 millions d’années, au temps des dinosaures, sa concentration était 20 fois supérieure. Quelle chaleur : heureusement, la photosynthèse est passée par là ! D’où notre pensée chimique du jour :
«Le dioxyde de carbone ne s’use pas, même si l’on s’en sert !»
Sources :
– http://fr.wikipedia.org/wiki/Dioxyde_de_carbone
– http://en.wikipedia.org/wiki/Carbon_dioxide
– www.actu-environnement.com/ae/dictionnaire_environnement/definition/dioxyde_de_carbone_co2.php4
– www.inrs.fr/htm/intoxication_par_inhalation_de_dioxyde_de_carbone.html
– http://encyclopedia.airliquide.com/encyclopedia.asp?CountryID=19&GasID=26&LanguageID=2
– www.snv.jussieu.fr/bmedia/Photosynthese-cours/17-calvin-etapes.htm (cycle de Calvin)
– http://fr.wikipedia.org/wiki/Cycle_du_carbone et http://cycleducarbone.ipsl.jussieu.fr/ (cycle du carbone)
– http://fr.wikipedia.org/wiki/Lac_Nyos
– http://fr.ekopedia.org/Gaz_à_effet_de_serre
– http://fr.ekopedia.org/Stockage_géologique_du_CO2
– www.ipcc.ch/flot/special-reports/srccs/srccs_spm_ts_fr.flot (rapport du GIEC sur le piégeage et le stockage du dioxyde de carbone)

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie 

