L’étain est l’élément métallique de numéro atomique 50 et de masse atomique M = 118,7. Son nom vient du latin « stannum » qui dans l’Antiquité désigna d’abord un alliage d’argent et de plomb. L’étain a un point de fusion assez bas : 232°C. Assez malléable et moyennement ductile, c’est un bon conducteur électrique σ = 9 10 6 S.m-1.
Sa configuration électronique [Kr]4d105s25p2 lui permet d’avoir deux états d’oxydation : Sn4+, [Kr]4d10 très stable, et Sn2+ [Kr]4d105s2, moins stable. Du point de vue cristallin, il peut exister sous plusieurs formes :
– à température ambiante, il est quadratique sous forme β-étain, blanc, de densité 7,29,
– chauffé au-dessus de 162 °C, il devient orthorhombique et la variation de structure le rend très cassant,
– au-dessous de 13 °C, l’étain blanc se transforme lentement en étain gris : c’est la forme α, cubique, aux très basses températures. Au-dessous de -50 °C la transformation est rapide et le fait tomber en poussière.

Les premières mines d’étain à l’Ère romaine se trouvaient en Cornouaille et au Portugal. On en trouvait aussi en Bretagne et près de Nantes, mais les chaldéens les phéniciens et les carthaginois connaissaient avant cela l’étain et avaient organisé un riche commerce avec l’Europe, l’étain étant nécessaire à la fabrication des armes et du bronze. Car l’étain a de multiples utilisations.

Le fer blanc est constitué par une tôle fine d’acier revêtue d’une fine couche d’étain obtenue par trempage dans un bain d’étain fondu ou par électrodéposition. La plupart des boites de conserves et les boites boissons étaient en fer blanc. Avec l’augmentation du prix de l’étain et la concurrence de l’aluminium (cf. Aluminium), on remplace souvent l’étain par un vernis polymère (cf. Acides phtaliques) inerte sur l’acier.
L’étamage procède également de la même technique, les pièces étamées sont réalisées en fondant une couche fine d’étain sur l’objet pour des raisons alimentaires ou pour améliorer les contacts électriques.


La vaisselle en étain qui, aux XVIIe et XVIIIe siècles, remplace sur les tables de l’aristocratie et de la grande bourgeoisie la vaisselle d’argent, laisse la place au XIXe à la faïence et à la porcelaine et les objets de table deviennent alors des motifs de décoration recherchés par les antiquaires.
La mode « chaumière rustique » dans les années 80 privilégia les étains anciens et on vieillit artificiellement des pièces neuves par oxydation pour retrouver la teinte grisâtre et mate des objets anciens.
Une niche d’utilisation est celle des fils supraconducteurs pour les aimants à très haut champ magnétique utilisés pour la résonance magnétique nucléaire (RMN) et l’imagerie médicale. Ils sont formés in situ par recuits dans une gaine de cuivre afin d’obtenir Nb3Sn qui a une température critique de 19 K et peut remplacer les alliages NbTi dans ces dispositifs.
Alastair Pilkington, ingénieur anglais génial, s’est efforcé durant près de trente ans à fabriquer des verres plats épais polis (les glaces) sur un lit d’étain fondu. Après avoir failli être ruiné, la mise au point d’alliages ayant le bon point de fusion, la protection de l’oxydation par un gaz réducteur au dessus du bain, son procédé « float-glasss » a conquis le monde entier.

La découverte récente près de Vilnius en Lituanie d’un charnier de soldats de la Grande Armée napoléonienne morts lors de la retraite de Russie, semble accréditer la légende des boutons en étain qui tombaient en poussière par froid intense (transformation structurale rapide à -50 °C). En effet, dans ce charnier les boutons en cuivre retrouvés semblent avoir joué un rôle anti-bactérien, puisque les uniformes avaient été préservés en grande partie, mais de boutons d’étain, point !
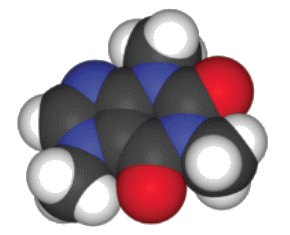
En chimie organique, le chlorure stannique, SnCl4, est utilisé comme déshydratant et le tributylétain, (C4H9)3SnH, était utilisé comme agent antisalissure (antifouling) dans les peintures de coques des bateaux. Comme il est toxique pour l’environnement, son usage est maintenant très limité.
L’étain est actuellement un élément déjà rare. Au rythme actuel de consommation, les ressources minières raisonnablement exploitables, ne nous laissent guère plus de 25 à 28 ans d’usage. Les principaux producteurs sont la Chine (40 %), l’Indonésie et le Pérou. La Chine, comme à son habitude, est devenue le plus gros consommateur et impose des quotas à l’exportation. Les réserves estimées sont de l’ordre de 6 Mt. La consommation actuelle est comprise entre 270 000 et 300 000 t/an, selon les années et le prix qui en 2000 était de l’ordre de 3 600 €/t, est monté à 15 500 €/t fin 2011, après avoir atteint un sommet à 23 200 €/t en avril 2011. Les besoins en électronique ne cessent de croître et le recyclage est faible.
Pensée du jour
De bronze en fer blanc, de pots en cloches, l’étain se serait-il invité dans la guerre des boutons ?
Sources
– http://fr.wikipedia.org/wiki/étain
– https://www.etainpassion.com/etain/alliage.asp
– https://www.etainpassion.com/etain/metal.asp
– http://terresacree.org/etain.htm
– http://fr.wikipedia.org/wiki/étamage
– http://fr.wikipedia.org/wiki/Fer-blanc
– http://en.wikipedia.org/wiki/Tin
– http://minerals.usgs.gov/minerals/pubs/commodity/tin/index.html#myb
– www.periodicvideos.com/videos/050.htm
Pour en savoir plus
– Cuivre
– Aluminium
– Acides phtaliques
– Plomb
– Antimoine

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie