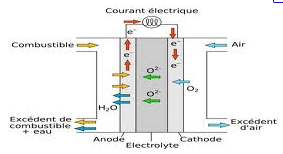
La pile à combustible (PAC) fournit de l’énergie grâce à l’oxydation d’un combustible (H2, CH4, CH3OH…) à l’anode et la réduction d’un oxydant (O2 ou l’air) à la cathode. Dans le cas du dihydrogène (cf. Hydrogène), la réaction finale est bien connue : H2 + 0,5 O2 ———> H2O + Q
Dans la réalisation pratique, un électrolyte solide ou liquide sépare le compartiment anodique où arrive le dihydrogène du compartiment cathodique où arrive le dioxygène (cf. Dioxygène). Cet électrolyte doit laisser passer les ions O2-, mais faire obstacle aux électrons qui doivent alimenter le circuit extérieur.
On attribue au chimiste William Grove la découverte du principe de la pile à combustible et les premières réalisations en laboratoire (1839 -1840) en utilisant l’acide sulfurique (cf. Acide sulfurique) comme électrolyte.
Il fallut attendre près de 100 ans pour que Francis T. Bacon reprenne les études sur ce sujet et réalise en 1935 la première pile hydrogène/oxygène en milieu potassique, KOH (cf. Potassium), et construira en 1953 et 1959 des prototypes de puissance 1 et 5 kW qui furent adoptés par la NASA pour les vols spatiaux habités et rendus célèbres par la mission à problème Apollo XIII.
La réussite technologique de ces vols et les préoccupations californiennes d’amélioration de la qualité de l’air des villes américaines qui aboutit au « Clean air Act » aux États-Unis en 1970, suivi par la première crise pétrolière en 1973, remit au gout du jour les recherches sur les PAC. Depuis plus de trente ans, ces recherches aux États-Unis, en Europe, au Japon et maintenant en Chine, ont conduit à des prototypes de plusieurs MW et à des produits commercialisés, surtout pour les modèles fixes.
Le début du XXIe siècle et les sommets atteints par le baril de pétrole et le prix de l’essence à la pompe ont à nouveau encouragé la recherche et l’élaboration de prototypes de PAC embarqués sur les véhicules automobiles.
En effet les piles à combustibles ont quelques avantages :
– celles utilisant dihydrogène et dioxygène ne rejettent que de la vapeur d’eau : c’est donc une technologie propre. Si un autre combustible, comme le gaz naturel, est utilisé, les émissions de dioxyde de carbone (cf. Dioxyde de carbone) sont un peu plus faibles qu’avec un moteur thermique ;
– le rendement de la conversion est très élevé : 50 % en énergie électrique et 80 % en rendement global si l’on utilise la chaleur dégagée pour une cogénération ;
– silencieux, les PAC n’ont pas de pièces mobiles ;
– simples à utiliser, car la production électrique ne passe pas par le circuit classique des centrales thermiques : combustion – vapeur – turbine mécanique – générateur électrique ;
– les PAC peuvent utiliser plusieurs types de combustibles gazeux ou liquides.
Il existe plusieurs types de piles à combustibles, suivant la nature de l’électrolyte (solide, acide, base), la nature du combustible, l’oxydation directe ou indirecte, la température de fonctionnement.
On distingue :
– AFC (Alcaline Fuel Cell) : pile à électrolyte alcalin (KOH) liquide ;
– PEMFC (Proton Exchange Membrane Fuel Cell) : pile à électrolyte polymère solide et à échange de protons H+ ;
– PAFC (Phosphoric Acid Fuel Cell) : pile à acide phosphorique H3PO4 (cf. Acide phosphorique)
– MCFC (Molten Carbonate Fuel Cell) : pile aux carbonates fondus (Li2CO3, K2CO3)
– SOFC (Solid Oxide Fuel Cell) : pile à électrolyte solide, de type oxyde
Le tableau suivant résume les principales caractéristiques de ces différents dispositifs :
– Les recherches et les principaux développements se font autour de deux types principaux:
– les PEMFC pour une température de fonctionnement assez basse, une technologie tout solide et des dimensions assez compactes ;
– les SOFC pour une valorisation intéressante dans un cycle combiné avec utilisation des rejets thermiques, et un rendement total électrique + thermique de l’ordre de 80 %, avec encore ici une technologie tout solide.
Les PEMFC
Ce sont des piles à membranes polymères, la plus courante est le Nafion® développé par DuPont de Nemours, copolymère FEP fonctionnalisé par des groupements acide sulfonique (cf. Téflon & Cie), qui doit être humide pour transporter les protons H+. Plusieurs programmes européens cherchent d’autres polymères tels que les dérivés du polybenzimidazole plus résistants et moins chers. L’autre domaine de recherche est de diminuer la quantité de platine dans le catalyseur, métal rare et coûteux (cf. Platine), avec comme objectif 0,1g Pt/kW. La compacité des piles est aussi un objectif permanent avec des membranes de l’ordre de 15 à 50 µm, des anodes en carbone poreux et des plaques bipolaires en acier inoxydable. La durée de vie peut aussi être améliorée, car d’une part des traces de monoxyde de carbone (cf. Monoxyde de carbone) de l’ordre de quelques ppm dans l’hydrogène sont de véritables poisons pour le catalyseur et d’autre part, le contrôle de l’eau dans le polymère est impératif. Au lieu de l’hydrogène on peut utiliser l’alcool ou le méthanol en oxydation directe, mais cela demande aussi un étage catalyse en amont.
– L’utilisation des PEMFC embarquées sur des véhicules automobiles se heurte à deux difficultés :
– la quantité de platine au cm2 de membrane, qui doit encore diminuer pour une utilisation massive ;
– le stockage de l’hydrogène sous haute pression (700 bar) ou liquide et la chaîne de distribution de ce vecteur énergétique encore à organiser.
Le CEA, le CNRS et l’IFP Energies nouvelles on fait faire des progrès considérables à cette technologie dans le cadre de plusieurs programmes internationaux.
Les SOFC
Prévues presqu’essentiellement pour des installations fixes, elles fonctionnent à des températures élevées, entre 800° et 1 000 °C. Dans ce type de pile, les ions oxygènes sont déplacés à travers un oxyde solide, conducteur ionique. Celui-ci est majoritairement de la zircone, ZrO2 (cf. Zirconium) stabilisée à l’yttrium (cf. Yttrium) ou par la chaux, CaO (cf. Chaux). Les ions oxygène vont alors réagir à{ la cathode avec le dihydrogène ou un gaz combustible comme méthane (cf. Méthane), propane ou butane. Les rejets gazeux après réaction sont de la vapeur d’eau pour le dihydrogène et un mélange CO2 + H2O pour les autres gaz. Ces rejets, qui sont à haute température peuvent être utilisés pour alimenter une turbine à gaz pour accroître le rendement électrique et même ensuite réchauffer de l’eau chaude à travers un échangeur pour le chauffage d’un immeuble.
Plusieurs configurations sont proposées, soit planaires où les couches minces de céramique sont pressées et compactées ensembles avec les connections électriques, soit cylindriques où les cellules sont sous forme de tubes creux assemblés. La montée en température de ces assemblages céramiques demande un soin particulier pour éviter les contraintes mécaniques. Ces électrodes n’ont pas besoin de catalyseur onéreux. Il importe cependant que les composés soufrés présents dans les gaz soient éliminés. Les recherches actuelles tendent à trouver des conducteurs ioniques à plus basses températures comme les chromites de terre rares ou des céramiques à base de cérine, CeO2 (cf. Cérium) et gadolinium (cf. Lanthanides). Un point également crucial est la durée de vie des connecteurs et des joints d’étanchéité. Les recherches et développement ont permis à plusieurs entreprises comme Siemens, Westinghouse, Sulzer… de commercialiser des piles de quelques dizaines de KW à quelques dizaines de MW.
Pensée du jour
«Les PACS constituent le bon mariage entre l’énergie et l’environnement.»
Sources
– http://fr.wikipedia.org/wiki/Pile_à_combustible
– Th. Alleau, F. Barbier, {L’Actualité Chimique 2001, 248, 49-57.
– F. Lapicque et al., {L’Actualité Chimique 2010, 338-339, 81-91.
– www.cea.fr/var/cea/storage/static/fr/jeunes/animation/aLaLoupe/Pile/pile.htm
– http://pileacombustible.free.fr/index2.htm
– http://en.wikipedia.org/wiki/Fuel_cell
Pour en savoir plus
– Hydrogène
– Dioxygène
– Acide sulfurique
– Potassium
– Dioxyde de carbone
– Monoxyde de carbone
– Acide phosphorique
– Téflon & Cie
– Platine
– Zirconium
– Yttrium
– Chaux
– Méthane
– Cérium
– Lanthanides

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie