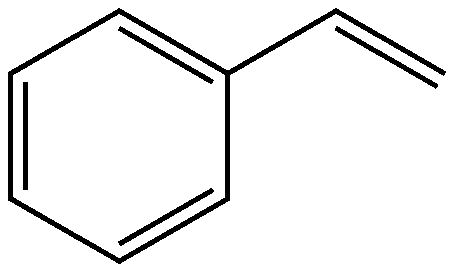
Le Styrax benzoin est une des rares plantes à avoir donné son nom de genre au styrène et son nom d’espèce au benzène (cf. Benzène). Loin de la poésie de Raymond Queneau, des images d’Alain Resnais et de la voix de Pierre Dux, le styrène, issu de l’union du benzène et de l’éthylène (cf. Éthylène) bénie par MM. Friedel et Crafts (cf. Charles Friedel) est, par son tonnage (environ 25 Mt/an), le premier grand intermédiaire préparé à partir de briques élémentaires de la pétrochimie.
Autour de 1835, le pharmacien berlinois Eduard Simon, en distillant « l’ambre liquide » issue de S. benzoin, obtient un liquide incolore qu’il baptise styrène en référence au nom de la plante. En chauffant ce liquide, il obtient une substance solide, qu’il suppose être de l’oxyde de styrène.
Au passage, on découvre quelques protagonistes de la caractérisation du benzène : August Wilhelm von Hofmann, alors londonien, et son collaborateur, John Blyth, découvrent en 1845 par analyse élémentaire que la composition n’a pas changé au cours de la transformation, mais il faut attendre 1866 pour que Marcellin Berthelot fournisse une interprétation correcte du phénomène : il s’agit d’une réaction de polymérisation. Hermann Staudinger écrit dans sa thèse que le chauffage du styrène entraîne une réaction en chaîne qui se traduit par l’apparition de macromolécules de polystyrène. Tout est en place pour le développement industriel de ce monomère…
En fait, le styrène possédant un groupement vinyle est très sensible à la polymérisation. Le styrène liquide commence à polymériser à la température ambiante en formant un liquide jaune visqueux. Il peut être stabilisé par l’ajout de 50 ppm d’hydroquinone. Cependant, cette stabilisation n’est effective que pour de faibles quantités d’oxygène. La polymérisation est très nettement accélérée par la lumière. Le comportement du styrène en réaction de polymérisation est assez inhabituel : il peut subir des réactions de polymérisation de type radicalaire, tout comme des polymérisations anioniques ou cationiques que l’on développera dans un autre produit du jour consacré au polystyrène.
Avant 1930, date à laquelle des procédés de fabrication du styrène commencent à être développés, il le styrène était obtenu par distillation fractionnée lors du raffinage du pétrole. Actuellement, le styrène est préparé au départ de l’éthylbenzène.
L’éthylbenzène est produit par des variantes de la réaction de Friedel-Crafts : C6H6 + C2H4 ———> C6H5CH2CH3
au contact de catalyseurs acides. L’essentiel des procédés emploient le trichlorure d’aluminium comme catalyseur acide, avec le souci de réduire au maximum la quantité employée et d’en assurer le recyclage. La réaction n’est pas sélective puisque jusqu’à 15 % de diéthylbenzène sont formés et doivent être recyclés, après séparation, par désalkylation au contact… de trichlorure d’aluminium. L’emploi de catalyseurs acides à base de zéolithes est actuellement en cours de développement pour éviter l’emploi de trichlorure d’aluminium et la formation de produits secondaires.
Il existe principalement deux procédés de transformation de l’éthylbenzène en styrène :
– Le premier est un procédé de déshydrogénation catalytique. Le styrène est obtenu par chauffage vers 600 à 650 °C d’éthylbenzène en présence d’un catalyseur à base d’oxyde de fer dopé par des oxydes de chrome et de potassium.
– Le second procédé, moins utilisé, s’effectue en plusieurs étapes et résulte d’une coproduction d’époxypropane (oxyde de propylène, C3H6O) et de 1-phényléthanol. L’éthylbenzène est d’abord oxydé à 150 °C sous une pression de 2 bar. L’hydroperoxyde formé réagit ensuite avec du propylène à 115 °C sous pression élevée et en présence de silice pour former l’époxypropane et le 1-phényléthanol. Ce dernier subit ensuite une déshydratation à 200 °C environ en présence d’alumine pour former le styrène.
L’inhalation de concentrations élevées de styrène peut occasionner des troubles du système nerveux, tels que de la dépression ou des difficultés de concentration, de la faiblesse musculaire, des nausées ainsi qu’une irritation des yeux, du nez et de la gorge. Plusieurs études effectuées sur une population de salariés exposés au styrène ont mis en évidence un risque de leucémie. Des études sur des animaux ont montré que le styrène est faiblement cancérogène par inhalation ou ingestion. Très récemment, le National Institutes of Health a classé le styrène dans la liste des molécules cancérigènes chimiques et biologiques. Toutefois, le NIH souligne que l’exposition la plus importante provient du tabagisme…, d’où la
Pensée du jour
« Styrène : attention aux chants des sirènes… »
Sources
– www.imdb.fr/title/tt0051471/
– http://fr.wikipedia.org/wiki/Éthylbenzène
– www.societechimiquedefrance.fr/extras/Donnees/orga/etbenz/cadetb.htm
– http://en.wikipedia.org/wiki/Ethylbenzene
– www.inrs.fr/htm/ethylbenzene.html
– http://fr.wikipedia.org/wiki/Styrène
– http://en.wikipedia.org/wiki/Styrene
– www.inrs.fr/htm/styrene.html
– www.lemonde.fr/planete/article/2011/06/11/le-formaldehyde-et-le-styrene-rejoignent-la-liste-des-substances-cancerigenes_1534802_3244.html
Pour en savoir plus
– Benzène
– Éthylène
– Charles Friedel

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie