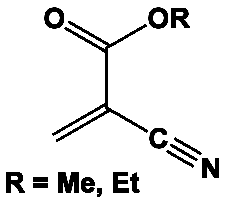
Il existe de nombreux acrylates, mais les deux principaux sont :
– le 2 cyanoacrylate de méthyle, C5H5NO2. Ce monomère liquide, de formule CH2=C(CN)COOCH3 a une masse moléculaire de 111 g,
– le 2 cyanoacrylate d’éthyle, C6H7NO2, de formule CH3-CH=C(CN)COOCH3, a une masse moléculaire de 125 g.
Les autres cyanoacrylates ont des masses moléculaires plus élevées comme par exemple le cyanoacrylate d’octyle, ce qui entraîne un temps de prise plus long et des applications macromoléculaires.

Kodak, voyant l’intérêt de ce nouvel adhésif le commercialisa sous le nom « Eastman 910 ». Ce n’est qu’après 1960 lorsque Kodak vendit le cyanoacrylate à Loctite (maintenant dans le giron du groupe allemand Henkel) que des noms plus aguichants de « super glue » ou « crazy glue » apparurent sur le marché.
Ces monomères polymérisent rapidement en présence d’anions. La polymérisation démarre immédiatement en présence d’eau et la simple humidité de l’air suffit pour amorcer la réaction dont le principe est basé sur la réaction de Michael :

Les colles cyanoacrylates ont été rendues très populaires par les passionnés de bricolage, les amateurs de modèles réduits et les fans d’aquariophilie marine, sans oublier les artisans du travail du bois.
Les applications vétérinaires comme la réparation des os, du cuir et des écailles de tortue ont initié les applications médicales, notamment du 2-cyanoacrylate d’octyle, pour la fermeture des plaies plus sûre et plus fonctionnelle que par points de suture. Certains grimpeurs et guitaristes s’en enduisent volontairement les doigts pour leur protection et éviter les blessures. Cette propriété de pouvoir recoller des objets biologiques comme celle de recoller des morceaux de coraux sur une roche en gardant la propriété de pouvoir croître à nouveau est à l’origine d’une constatation accidentelle qui a des retombées toujours nombreuses dans la chasse aux malfrats.
On raconte en effet qu’un criminologiste utilisant le cyanoacrylate pour réparer son aquarium remarqua qu’à la fin de son travail les parois étaient recouvertes de ses empreintes qui apparaissaient très visibles. Cette remarque a toujours ses prolongements, puisqu’on utilise les vapeurs de cyanoacrylates sur les lieux de crimes, car elles réagissent avec les résidus d’empreintes digitales invisibles sur les surfaces non poreuses et l’humidité de l’air pour former un polymère blanchâtre qui révèle les dites empreintes.
Comme les colles agissent en quelques secondes, elles peuvent accidentellement coller la peau et les tissus humains. Il ne faut alors pas essayer de séparer de force les surfaces collées (doigts, lèvres…). On peut tremper les surfaces collées dans de l’eau tiède savonneuse ou une solution de bicarbonate de soude. Pour enlever les traces de colle sur la peau il faut utiliser quelques gouttes d’acétone (solvant du vernis à ongles), sauf évidemment si les zones collées sont les paupières ou les lèvres où il faut procéder très délicatement avec de l’eau tiède.
Une application plus récente est celle de nanoparticules de polyalkylcyanoacrylate fonctionnalisées pour le transport de molécules à propriétés antitumorales (Cf. Squalène). Ces nanoparticules sont obtenues par « click chemistry » par condensation-addition de cyanoacétate d’hexadécyle selon le schéma :
Pensée du jour
« Entre deux heures de colle et la colle minute y’a pas photo ! »
Sources
– http://fr.wikipedia.org/wiki/2-cyanoacrylate_de_méthyle
– http://en.wikipedia.org/wiki/Harry_Coover
– http://en.wikipedia.org/wiki/Cyanoacrylate
– Macromolecules 2008, 41(22), 8418
Pour en savoir plus
– Squalène

 Présentation
Présentation  Entités
Entités  Partenaires
Partenaires  Histoire de la SCF
Histoire de la SCF  Gouvernance
Gouvernance  Industrie
Industrie